医療従事者を対象としたサイトです


ここ数年,製薬企業が関連するセミナーやシンポジウム等において,これまでの営業系の部門とは独立したメディカルアフェアーズ(MA)部門が主催するケースが散見されるようになった。
学会展示場でも,MA部門によるメディカルブースが設置されていることがある。MA部門としての適切な運営とはどのようなものか。また,メディカルエデュケーション(ME)として,営業・マーケティング部門主催のものと異なる意義はあるのか。10月29日,日本製薬医学会第12回年次大会(大会長:松山琴音氏[日本医科大学])のシンポジウム2「MA部門が実施するメディカルエデュケーションイベントの意義と実践」において議論がなされ,臨床医からの視点も発表されたので紹介する(編集部)。
座長・コーディネーター:
西馬信一氏(ブリストル・マイヤーズ スクイブ株式会社)
村上寛和氏(メルクバイオファーマ株式会社)
演者:
柴 英幸氏(日本製薬工業協会 医薬品評価委員会 メディカルアフェアーズ部会)
村田 洋子氏(米国研究製薬工業協会[PhRMA],メディカルアフェアーズ部会)
横山 みなと氏(東京医科歯科大学大学院腎泌尿器外科学)
MAが主管となる学会セミナー,シンポジウム等やメディカルブースについて,日本製薬工業協会 医薬品評価委員会 MA部会は,関連する業界ルールや規制を整理・確認し,留意すべき点についてQ&Aにまとめ,2021年7月9日に発出している。
これによると,まず大前提として,ME会合およびメディカルブースは医療用医薬品の販売情報提供活動に関するガイドラインなどの「適応範囲外ではない」。自社規制により販売情報提供活動とMA部門が明確に切り離すことを規定している場合でも,薬機法や厚生労働省の医療用医薬品の販売情報提供活動に関するガイドライン等を遵守する必要がある。したがって,自社医薬品の未承認効能・効果および用法・用量に関する臨床試験データの提示は原則不可である。開催可能時期についても,薬機法第68条(承認前の医薬品等の広告の禁止)に基づき,承認前の販売活動と捉えられないよう留意する必要がある。自社医薬品の未承認薬・適応外薬等に関連する質問やデータ提示を求められた場合については,予想される適応外情報への対処を検討し,役割者に知らせておき,必要に応じて追って個別に回答するなどの慎重な対応を促している。
柴 英幸氏(アストラゼネカ株式会社,日本製薬工業協会 医薬品評価委員会 MA部会)は,MA部門が実施するものであればコマーシャル部門ではできないこともできるのではないか,と考えたり,コマーシャル部門や講演会演者も同様に誤解しているケースが散見されていたとし,1)従うべきルール/規制は営業等他部門と同じであるものの,2)企業内での企画・主管者の役割・責任は営業等他部門とは異なり(特定の医薬品の販売促進を意図しない),3)企画・主管者にはMAの有する高度な医学・科学的な専門性が求められる,と述べた。
村田洋子氏(ヤンセンファーマ株式会社,米国研究製薬工業協会[PhRMA]MA部会)は,PhRMAがまとめたMA部門が実施するMEに関するポジションペーパー(論文投稿中)について紹介した。
米国や欧州には医師生涯教育(CME)の科学的価値・商業バイアスの有無などについて審査する機関があり,その認定を受けたCMEを継続的に履修することを医師に義務づけている。一方,日本では日本医師会生涯教育制度などのCMEは存在するものの,諸外国と異なり医師免許の更新制度が存在しない。PhRMAは,現状の日本のCMEには内容や質(ニーズ,情報鮮度,頻度)・時間・予算といった課題があり,これについてMA部門が開催するMEが補完することができ,実施意義があると考えている。
製薬企業が実施するMEには厚生労働省の販売情報提供ガイドライン,製薬協のコード・オブ・プラクティスなどの規制があるが,これら規制はカスタマーニーズを満たす質の高いMEの提供を困難にしている側面もある。たとえば,他社の製品を含めた包括的な情報提供は想定されていない,販売促進を期待して行う「販売情報提供活動」の判断基準が不明確,開発中の製品に対する情報提供が大幅に制限されている,などである。
村田氏は,こうした一連の課題を解決するためには,各製薬会社が自社製品のプロモーションを目的とした講演会とは異なる質の高いMEを提供することにより,MEの位置づけが明確となり,その価値が規制当局を含め社会に広く認知されるように努めていくことが必要だと述べた。
臨床医の立場から登壇した横山みなと氏(東京医科歯科大学大学院腎泌尿器外科学)は,自分に限らず,臨床医はそもそも販売情報提供活動のルールについて知識がなく,MRとMSLの違いもわかっていないのではないかと指摘。そして,自身が演者として呼ばれた際の事例を交えて,5つの提言を発表した。
提言1)史実と考えられる事象については忠実な再現の許可を
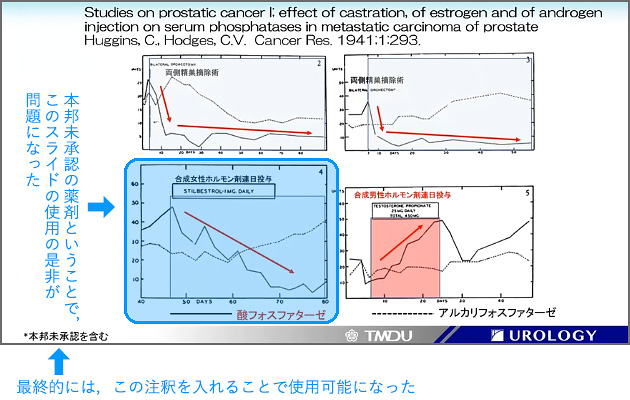
Huggins CBは,前立腺癌細胞がアンドロゲン(男性ホルモン)によって増殖することや,アンドロゲンの産生抑制やアンドロゲンの前立腺癌細胞への作用を防ぐホルモン療法が効果的であることを示し,1966年にノーベル生理学・医学賞を受賞している。これを証明した1941年の論文では,去勢術や女性ホルモン剤によって癌の縮小が可能であることを示しているが1),使用された合成女性ホルモン剤が本邦未承認であるため,ある講演会では,同論文の図(図1)の使用の是非が問題になったという。最終的に,その会では「*本邦未承認を含む」と注釈を記載することで使用可能になったというが,横山氏は「現代医学との線引きは難しいものの,史実と考えられる事象については,忠実な再現を認めてもらいたい」と述べた。
【図1:ノーベル生理学・医学賞受賞論文(1941年)であるが,使用された合成女性ホルモン剤が本邦未承認のため,使用の是非が問題になったスライド】

提言2)査読付き論文・重要学会発表の正確な引用の許可を
同じく前立腺癌の論文で,2000年にLancetに掲載されたアンドロゲン除去療法単独治療vs.複合アンドロゲン阻害療法のメタアナリシスがある(図2)2)。本邦未承認のnilutamideが含まれるため,ある講演会ではスライド使用が認められず,5年目の結果の数値のみを示すことになったという(図3)。図からは「両群の2年目までの生存率にほぼ差はなく,3,4年目の差もごくわずか」という情報が読み取れるが,5年目の数値だけをみると,ある程度差があるように思われる可能性がある。言葉で補ったとしても,意図を伝えきれなかったり,誤解されてしまう恐れがあることから,「一流,二流の線引きは難しいかもしれないが,一流紙に掲載された査読付き論文(特にメタアナリシス)の正確な引用については許可してもらえないだろうか。日本と海外で用法・用量が異なるため問題になることもあるが,このあたりも注釈記載などで柔軟に運用して欲しい」と横山氏は述べた。なお,他の会社のある講演会では,このスライドについて「*本邦未承認を含む」と注釈を記載することで使用可能になったという。
【図2:メタアナリシスに本邦未承認のnilutamideが含まれるため,使用が認められなかったスライド】


提言3)保険適用/適応外の概念の柔軟な適用を
また,横山氏は自身の症例を紹介3)。膀胱子宮瘻の29歳女性で,2回目の帝王切開後,月経再開とともに周期的血尿が出現し,瘻孔に子宮内膜上皮が異所性生着しており子宮内膜症と同様の病態と考えられたため,リュープリン(LHRHアゴニスト)による偽閉経療法(6ヵ月)を行った。同薬は膀胱子宮瘻については未承認であるが,子宮内膜症として治療したもので,想定通り奏功し瘻孔はきれいに塞がった。添付文書の効果・効能に記載がない場合でも,専門的・医学的見地から判断され,広く適応外使用が認められている場合などは保険適用になるため,この投薬についてもレセプトの返戻なく治療できたが,「このような事例は,各社の講演会では紹介できないのではないか。『適応外』を広く解釈せず,柔軟に対応して欲しい」と要望した。
提言4)同効薬比較の発表許可を
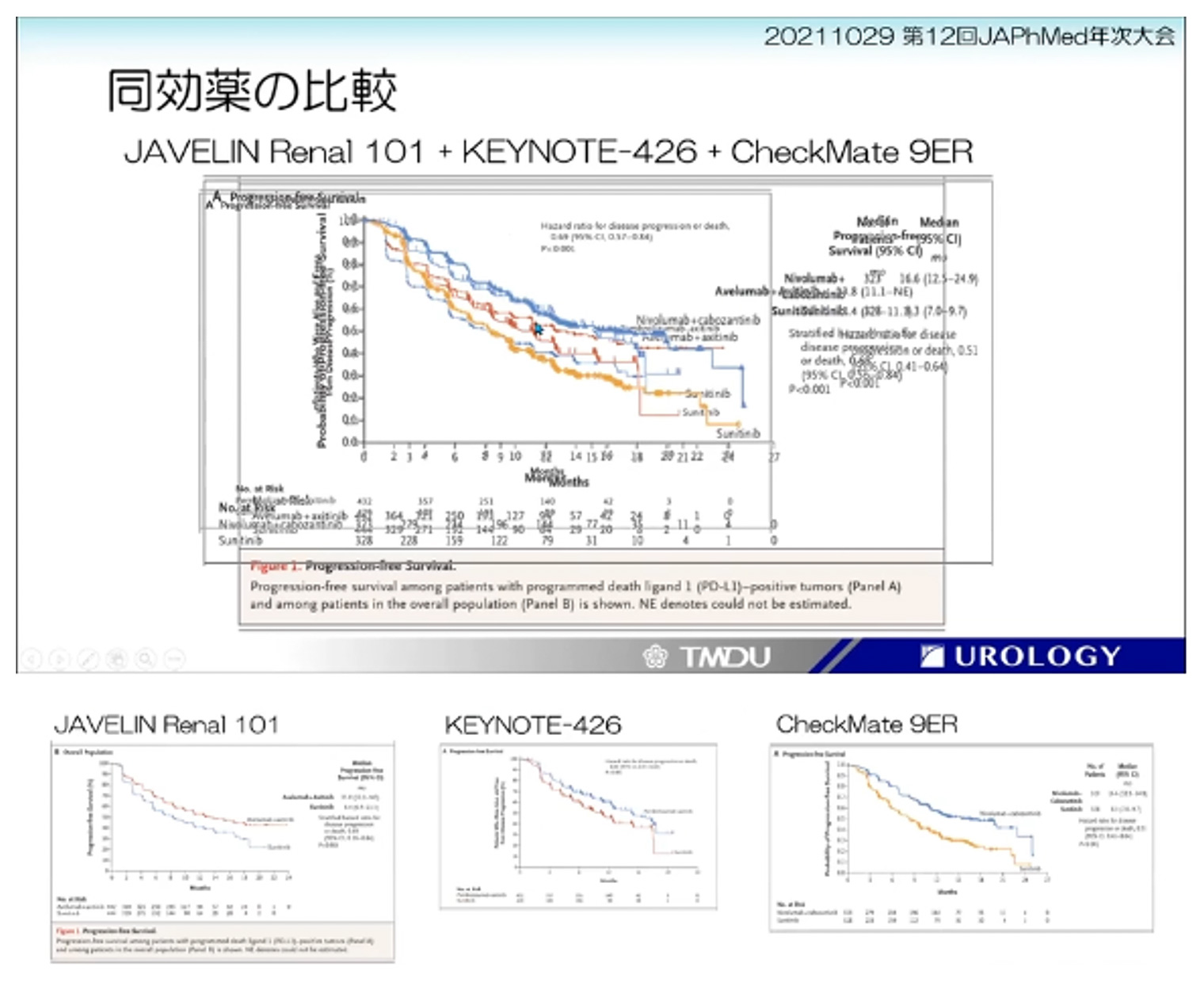
臨床医のニーズが高い同効薬の比較情報について,比較試験があれば薬剤選択は容易であるが,必ずしもそのような比較試験があるわけではなく,それぞれの第III相試験の結果を単独でみても,どれを選んだら良いかはわからない。臨床医は背景の違いを認識しつつ,各試験の要となるカプランマイヤー曲線を重ねて比較検討したりするが(図4),講演会ではこのような内容の発表は認められていない。「自分で検討すると手間がかかるので,誹謗の意図がない比較については講演会での発表を認めてもらいたい」と横山氏は述べた。
【図4:同効薬を比較したスライド】
このような情報は臨床医のニーズが高いが,講演会では発表できない

提言5)発売直前の新薬についての情報を含む講演の開催を
新薬の情報は,発売前は薬機法第68条(承認前の医薬品等の広告の禁止)に基づき,製薬会社から提供されず,講演会でも扱われない。情報不足のために,多くの臨床医は発売直後すぐに新薬を使い始めることができないという。横山氏は「論文に記載されない使用実感や,副作用について何に気をつけたらよいかなど,実際に治験に関わった人の話を聞きたい。治療を待つ患者さんのために,発売前から新薬についての情報が欲しい」と訴えた。
横山氏の提言について,ウェブ視聴者から「医学的には問題ないと思うが,製薬企業側は,医療用医薬品の販売情報提供活動に関するガイドラインの全国のモニター施設から不適切事例として通報されるのではないか,という懸念のため保守的な構えになっており,厚労省の見解が変わらない限り難しい」という意見が寄せられた。柴氏は「製薬企業側でも既存のルールを十分に理解,遵守したうえでMA部門の役割を確立し,その目的を周知浸透させていくように動かなければいけない。『MRがやっていたことを,いまはMSLがやっているんでしょう?』というような意見が出てこなくなるくらいにならないと変えられないだろう」と指摘。村田氏は「このような場で議論が出てくることが大切な第一歩だと思う。現状はMEといっても,想像するものが皆異なっている。MRとMSLの違いを含め,共通理解を得ることが大切だ」と述べた。
柴氏はさらに「現状のルールを変えることのみに主眼を置くのではなく,クオリティの担保されたMEコンテンツを作ることが大切なのではないか。現状はMA部門主催であっても『交通費を出します,食事の出る懇親会もありますので是非お越しください』というスタンスだが,本当に聞きたい,参加したいと思われるような,医療従事者のニーズが満たされるMEコンテンツがあればそれらは不要であり,それを目指すのが本流なのではないか」「MA部門主催のイベントはコマーシャル部門のものより内容が良いということではない。それぞれ役割が異なるために目指すものが異なっているのだから,これはMA部門でやるべきだ,これはセールスだ,と社内における差別化・棲み分けを議論するのではなく,社外の医療従事者のニーズを満たすため,それぞれのクオリティを高めることを目標とすべきだ」と述べた。
バックナンバー